Análise simplificada de pureza de produtos com Ginkgo.
A adulteração de ginkgo com rutina e quercetina ou com outros produtos ricos nesses flavonoides em produtos com ginkgo ainda é, infelizmente, uma prática comum. Produtos com ginkgo podem ser facilmente adulterados pela adição de rutina/quercetina, dos frutos ou botão de flores da sophora ou de erva de trigo sarraceno, o que diminui os custos para a produção de extrato de ginkgo seguindo os padrões de qualidade da USP.
Nesse caso, a técnica de HPTLC proporciona informações sobre identificação da planta (por meio de fingerprint), presença de adulterantes e conformidade com os limites de rutina e quercetina, tudo em uma única placa, economizando tempo e dinheiro adicionais em análises de rutina e quercetina por HPLC. Nesse exemplo vamos explicar como interpretar esses resultados em detalhes.
Metodologia utilizada:
- Solução padrão: Solução metanólica de rutina, ácido clorogênico e quercetina (2 mg/10 mL cada) para o teste de adequação do sistema; solução metanólica de rutina (0.4 mg/mL) e extrato padronizado em 0.5% de quercetina para o teste limite de detecção.
- Solução amostra: Produtos contendo extratos de gingko preparados para conter 10 mg/mL em extrato metanólico, sonicado por 10 min a temperatura ambiente e centrifugado por 5 min.
- Placa cromatográfica: HPTLC placa de sílica gel 60 F254 (Merck), 20 x 10*
*as placas cromatográficas da Merck também podem ser adquiridas pela AuTeC.
- Aplicação da amostra: Utilizando um aplicador automático (ATS4) ou o Linomat5, realizar 15 aplicações na placa, com bandas de 8 mm, distância entre as bandas de 11.4 mm, distancia da primeira aplicação com a borda esquerda da placa de 20 mm, distância da aplicação com a borda inferior da placa de 8 mm e volume de aplicação de 2 µ
- Desenvolvimento da cromatografia: Em uma cuba de desenvolvimento automático (ADC2), utilizando como fase móvel acetato de etila/ácido acético/ácido fórmico/água 100:11:11:26 depois da saturação por 20 min (com o papel de filtro) e ativação a 33 % de umidade relativa por 10 min usando uma solução saturada de cloreto de magnésio*. A distância de migração é de 70 mm (da borda inferior da placa). Secagem final de 5 min.
*Esse detalhe é essencial para a precisão da metodologia. O método não é robusto para mudanças na umidade relativa, fazendo com que os RFs mudem muito entre as placas.
- Derivatização pós cromatografia: A placa deve ser aquecida usando uma placa de aquecimento (TLC Plate Heater) a 100 °C por 3 min, depois imergir em reagente NP (1g difenilborato de 2-aminoetil em 200 mL de acetato de etila) utilizando o equipamento Immersion Device com imersão a uma velocidade de 3 cm/s e tempo de imersão de 0 s. Secar em ar a temperatura ambiente e fotodocumentar. Então imergir a placa em reagente anisaldeido (1mL de p-anisaldeido em 200 mL de uma mistura de metanol/ácido acético/ ácido sulfúrico 170:20:10) e aquecer novamente.
- Fotodocumentação: Utilizando o fotodocumentador TLC Visualizer 2 com as luzes UV 254 e 366 nm antes da derivatização, UV 366 nm depois da derivatização com NP e luz branca após derivatização com NP e anisaldeído.
Resultados e discussões:
Primeiramente iremos entender o resultado após a derivatização com o reagente NP sob luz UV 366 nm, no SST (solução para teste de adequação do sistema) podemos observar a rutina, ácido clorogênico e quercetina:

Temos várias informações importantes nessa foto:
- No geral, as amostras de 3 a 13 são menos intensas do que a do extrato padrão, porém existem bandas mais intensas na posição da rutina e quercetina e bandas adicionais não características do extrato padrão de ginkgo (evidenciadas pelas flechas azuis).
- Os adulterantes foram detectados nas amostras:
> 3 e 4: mancha intensa amarela na posição da quercetina
> 5 a 8: mancha intensa amarela na posição da quercetina; para a amostra 5 observamos perfil menos intenso que o do extrato padrão.
> 9 e 10: mancha intensa amarela na posição da rutina, perfil menos intenso que a do extrato padrão.
> 11: mancha intensa amarela na posição da rutina.
> 12: mancha intensa amarela na posição da quercetina, perfil menos intenso que a do extrato padrão.
> 13: não tem a presença da ginkgo, mas sim de 5-hidroxitriptofano.
Para o teste de pureza, amostras de frutas e botões de flores da sophora e erva de trigo sarraceno foram analisadas individualmente e misturadas com extrato de ginkgo. Abaixo temos a figura das amostras adulteradas em fases diferentes de derivatização e tipo de luz usada.

Amostra 1: Amostra adulterada com ≥ 15% de erva de trigo sarraceno. Placa não derivatizada com luz UV 366 nm. Evidenciado pela presença de duas manchas vermelhas presentes entre Rf 0.5 e 0.6.- Amostra 2: Amostra adulterada com ≥ 1% da fruta da sophora. Placa não derivatizada com luz 254 nm. Evidenciado pela presença de duas manchas com Rf 0.12 e 0.59.
- Amostra 3: Amostra adulterada com ≥ 3% da fruta da sophora. Placa derivatizada com regente NP com luz 366 nm. Evidenciado pela presença de uma mancha verde com Rf 0.17.
- Amostra 4: Amostra adulterada com ≥ 5% da flor de sophora. Placa derivatizada com reagente de NP e reagente anisaldeído. Evidenciado pela presença de duas manchas marrons com Rf 0.4 e 0.3 e uma zona intensa na posição da rutina.
Para teste limite de rutina e quercetina, imagens com luz UV 254 nm antes da derivatização e UV 366 nm depois da derivatização com reagente NP podem ser convertidos em picos cromatográficos através da análise dos pixels na imagem fotodocumentada através do TLC Visualizer 2. Os cálculos podem ser realizados através da altura dos picos. No teste realizado, os padrões foram preparados nas concentrações correspondentes ao limite máximo de aceitação da Rutina e Queretina segundo a USP.
A figura abaixo é do teste limite para rutina. Os cromatogramas são da placa antes da derivatização com luz UV 254 nm. Nesse caso conseguimos observar valores acima da especificação para as amostras 9, 10 e 11.
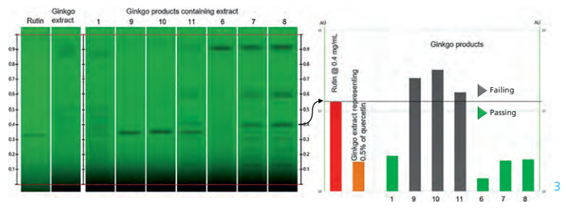
A figura abaixo é do teste limite para quercetina. Os cromatogramas são da placa depois da derivatização com reagente NP e com luz UV 366 nm. Nesse caso conseguimos observar valores acima da especificação para as amostras 6, 7 e 8.
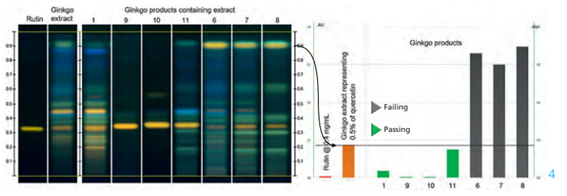
Esse estudo teve como objetivo realizar pequenas modificações na monografia da USP para tornar o método eficiente também para a identificação da pureza do produto. Isso agrega um enorme valor ao método, pois reduz o número de análise, comparada à monografia original da USP.

