A resposta a essa pergunta é sim: a fase reversa às vezes pode proporcionar uma melhor separação e, portanto, uma melhor purificação do que a fase normal. Quando é provável que a fase reversa seja a melhor escolha? Essa é provavelmente uma forma diferente e melhor de se fazer essa pergunta.
Neste post, tentarei demonstrar quando a fase reversa é provavelmente o melhor modo de purificação.
À medida que as misturas de reação se tornam cada vez mais complexas e polares, a tradicional metodologia de purificação flash em fase normal se torna cada vez menos eficaz. Historicamente, os químicos que purificam os compostos polares recorrem à sílica e a uma fase móvel do DCM + MeOH, que pode funcionar, mas geralmente é problemática e imprevisível, Figura 1.
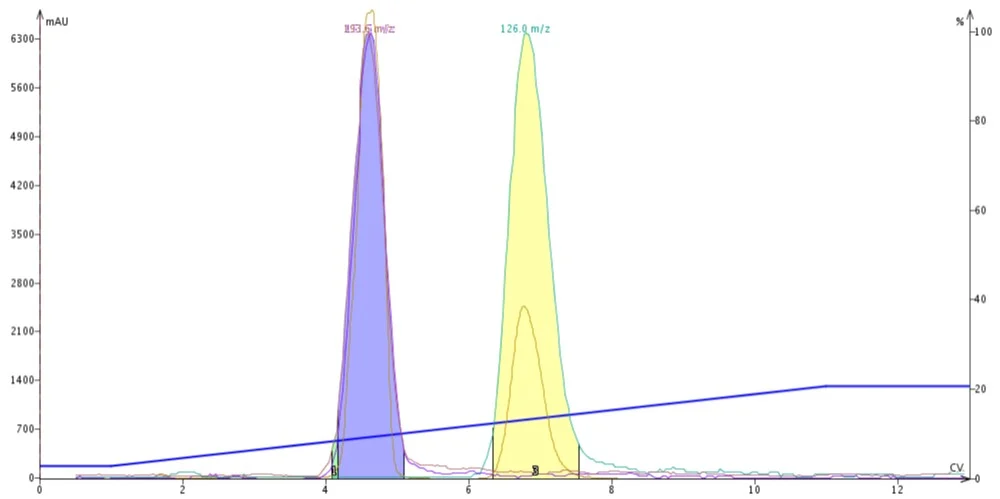
Figura 1. Purificação por DCM-MeOH de butil parabeno, metil parabeno e 4-metil-4 (5) – nitroimidazol. Devido à forte polaridade do metanol, os dois parabenos co-eluem (pico azul).
A cromatografia flash em fase reversa, embora exista há décadas, raramente é utilizada devido a preocupações com a evaporação de solventes e a contaminação do sistema pela água usando os métodos de fase reversa. A última preocupação é normalmente abordada através da realização de HPLC preparativa ou da compra de um segundo sistema flash dedicado apenas a aplicativos em fase reversa. Embora eficaz, isso adiciona um custo extra a um laboratório, um tópico abordado anteriormente.
Com a moderna tecnologia de evaporação, a primeira questão também não é grande coisa. Até 100% de água pode ser facilmente evaporada atualmente usando um sistema de evaporação como o Biotage® V-10 Touch.
Voltando ao tópico, quando é provável que a fase reversa seja a melhor opção para o modo de purificação? Para responder a isso, vamos pensar na teoria do mecanismo de separação química e cromatográfica de nosso composto. Se você se lembra, a cromatografia em fase normal realizada com sílica ou alumina utiliza um mecanismo de separação de adsorção e dessorção. Basicamente, os compostos polares são adsorvidos através de interações polares com a área superficial do sorbente e permanecem lá até que a polaridade do solvente seja alta o suficiente para dessorvê-los. Uma vez dessorvidos, os compostos permanecem em solução e eluem da coluna.
Portanto, compostos com diferentes funções polares provavelmente exibirão diferentes cinéticas de adsorção / dessorção e eluirão em momentos diferentes durante um gradiente. Compostos muito polares exigem solventes de polaridade mais alta para que sejam dessorvidos e alterações muito leves na concentração do modificador polar podem causar dessorção dos compostos, tornando a otimização do método um desafio. Às vezes, é necessária uma alteração no modificador polar para concluir a tarefa, Figura 2.
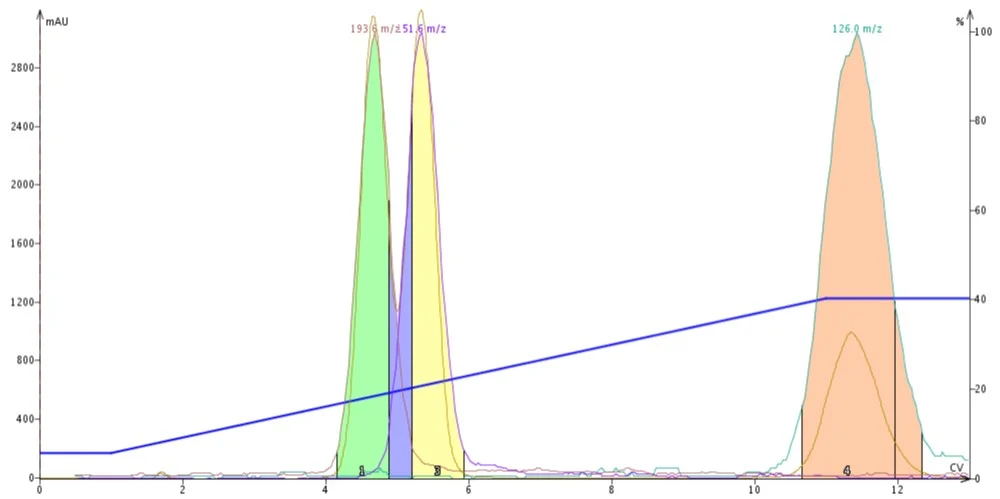
Figura 2. Purificação gradiente de DCM-ACN de butil parabeno, metil parabeno e 4-metil-4 (5) -nitroimidazol. Ao substituir o metanol prótico por acetonitrila aprótico, é realizada uma separação dos parabenos.
Agora, vamos pensar no mecanismo de separação em fase reversa. Esse é um mecanismo de particionamento semelhante à extração líquido-líquido, exceto que é uma extração líquido-sólido. Com a fase reversa, os compostos são atraídos para o meio em fase reversa através de interações hidrofóbicas. Durante o gradiente de eluição, os compostos começarão a ter sua cinética de partição alterada com o aumento do teor de solvente orgânico e começarão a eluir. Quanto mais hidrofóbico for o composto, maior será a retenção e mais solvente orgânico será necessário para elui-lo.
Durante um recente exercício de treinamento usando um sistema Biotage® Selekt com novos membros da equipe, pude demonstrar isso facilmente usando uma mistura de metil e butil parabeno dissolvido em acetona (Figura 3).
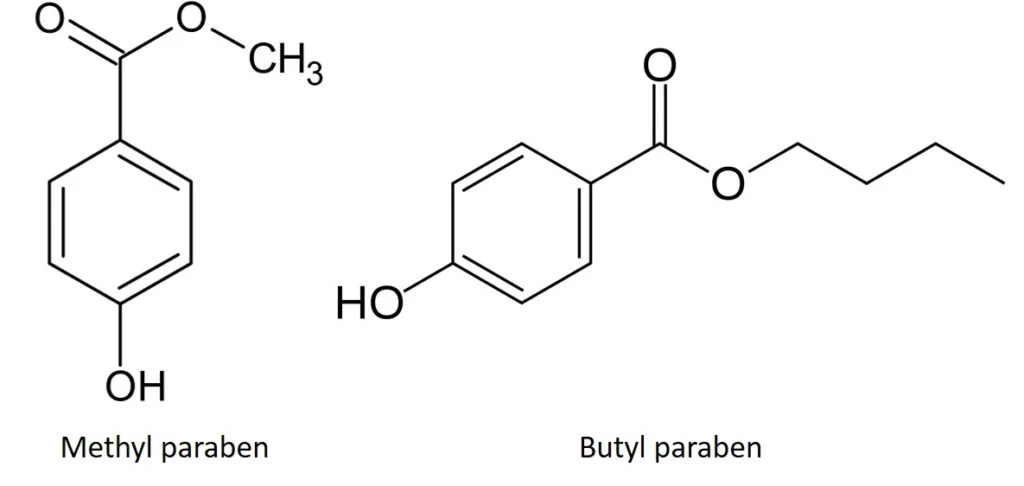
Figura 3. Metil e butil parabeno têm polaridade semelhante, mas hidrofobicidade diferente.
Eu os fiz realizar TLC com esta mistura em 20% de acetato de etila, que forneceu valores de Rf de 0,38 (butil) e 0,30 (metil) e, em seguida, criar um método em fase normal a partir dos dados da TLC, Figura 4.
Figura 4. O método gradiente com base em 20% de acetato de etila / hexano A TLC começa em 5% de acetato de etila e termina em 40%.
A mistura de parabenos, 100 mg, foi aplicada a um cartucho Samplet® preenchido com ~ 1 grama de ISOLUTE® HM-N, uma terra de diatomáceas refinada e deixada secar. Após o equilíbrio da coluna, o cartucho Samplet foi inserido na coluna de purificação (uma coluna de sílica Biotage® Sfär de 5 gramas, 20 µm) e a purificação foi iniciada. Os resultados mostraram uma boa separação, considerando que há muita pouca diferença de polaridade entre os dois parabenos, Figura 5.
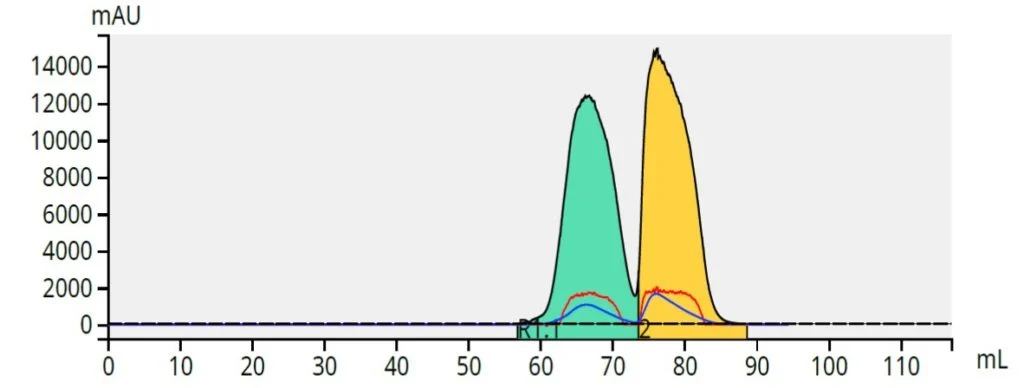
Figura 5. Separação de uma mistura de 50 mg de butil (verde) e 50 mg de metil (amarelo) parabeno usando um gradiente de 5-40% de acetato de etila / hexano e uma coluna Biotage® Sfär de 5 gramas, 20 um.
Existe, no entanto, uma grande quantidade de diferença de hidrofobicidade entre esses compostos a serem explorados, pois um possui um único grupo metil como parte do éster e o outro um grupo butil, tornando-o muito mais hidrofóbico. Devido a essa diferença de 3 carbonos, a fase reversa deve proporcionar uma separação muito boa.
Começando com uma fase móvel de 1: 1 de metanol / água, um gradiente linear para 100% de metanol em 10 volumes de coluna (CV) foi criado e usado no mesmo sistema Biotage Selekt (possui dois caminhos de fluxo independentes e alterna automaticamente entre solventes em fase normal e solventes em fase reversa em menos de 15 segundos). Os resultados mostraram uma excelente separação para a mesma carga de amostra (100 mg) usando uma coluna Biotage® Sfär C18 de 6 gramas, ~ 27 µm, Figura 6.
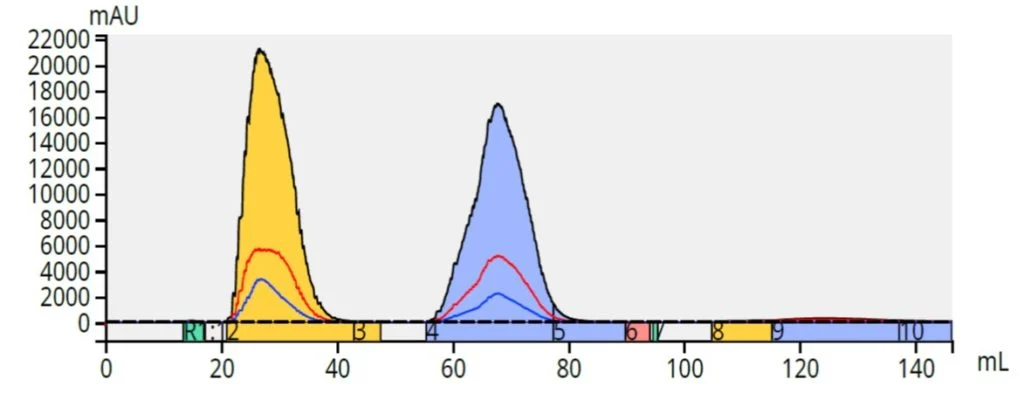
Figura 6. A purificação em fase reversa de metil e butil parabeno (50 mg cada) em uma coluna Biotage® Sfär C18 de 6 gramas é superior à separação em fase normal com a mesma carga na coluna do mesmo tamanho.
Portanto, sim, a fase reversa pode proporcionar uma separação melhor do que a fase normal, especialmente quando as moléculas diferem mais em hidrofobicidade do que em polaridade.

